10 научных иллюстраций, которые на самом деле должны выглядеть иначе

Ребята, мы вкладываем душу в AdMe.ru. Cпасибо за то,
что открываете эту
красоту. Спасибо за вдохновение и мурашки.
Присоединяйтесь к нам в Facebook и ВКонтакте
Мы привыкли верить, что школьный учебник, а уж тем более научная энциклопедия, никогда нас не обманет. Но даже самые авторитетные источники не могут гарантировать абсолютную достоверность. Ради красоты, удобства и привычки нам приходится жертвовать правдой.
АdMe.ru предлагает вам убедиться, что некоторые знакомые каждому иллюстрации на самом деле должны выглядеть иначе.
1. Модель атома
Классическую планетарную модель атома, которая красуется на обложках учебников, предложил Резерфорд в 1911 году. Но даже с появлением современных электронных микроскопов, позволяющих рассмотреть атомы, все же увидеть, из чего состоит отдельный атом, невозможно: настолько он маленький. Поэтому то, что электроны движутся вокруг ядра, как планеты вокруг Солнца, всего лишь предположение. А как выглядят электроны, мы и вовсе не представляем.
2. Молекула ДНК
А вот молекулы ДНК намеренно рисуют не так, как они выглядят на самом деле. Цель картинки из школьного учебника биологии не показать молекулу ДНК, а дать представление об основных принципах работы на примере ее модели. На самом деле ДНК выглядит не столь красочно.
3. Карта мира
Еще одно допущение, с которым мы должны мириться, — это карты мира. Передача трехмерного объекта, коим является планета Земля, при помощи плоского изображения невозможна. Любая карта мира, страны или местности — это всего лишь проекция. Самая известная проекция, которая стала нам родной на уроках географии, — проекция карты мира Герарда Меркатора. Тем, кто не готов смириться, что Гренландия гигантская, Австралия маленькая, Тихий и Атлантический океаны одного размера, а полюса тянутся к бесконечности, стоит пользоваться глобусом.
4. Схема Солнечной системы
Достоверно передать расстояния сложно даже в контексте земных объектов, поэтому не стоит полагать, что схема Солнечной системы отражает все масштабы правдиво. Космические расстояния даже представить сложно, не то что изобразить. Планеты Солнечной системы расположены друг от друга очень далеко. А схема, где они выстроились в ровный ряд, показывает лишь их условное расположение. Расстояние между Землей и Луной — около 400 тыс. км, что с некоторыми оговорками можно изобразить так, как на картинке выше.
Фото молекулы — Знания по физике и не только — ЖЖ
Ребята из IBM в Цюрихе получили уникальную фотографию молекулы, на которой видны разные типы связей между атомами (фото из журнала «Science»).
.
Чтобы получить такое фото, задействовали технологии AFM (микроскопия атомарных сил). Суть метода заключается в том, что образец «постукивают» иголкой, на конце которой может быть всего одна молекула. Специальные датчики фиксируют малейшее отклонение иголки. На основе этих данных моделируется компьютерное изображение.
Как вы понимаете, малейшие вибрации и колебания атомов сделают картинку размытой и не читаемой. Поэтому были приняты специальные меры, чтобы погасить вибрации внутри и снаружи лаборатории. Чтобы убрать тепловые колебания атомов образца и иголки, технику охладили до -268 градусов по Цельсию. В качестве иголки использовали оксид углерода.
На фото вы видите фуллерен, молекулу в виде футбольного мяча, состоящую из атомов углерода. Яркие участки соответствуют высокой концентрации электронов. Можно оценить длину электронной связи и увидеть разные типы связей между атомами.
В настоящее время команда ученых изучает пленку графен,толщиной в один атом углерода. Особенно их волнуют дефекты пленки, которые позволят изменять ее свойства, как когда-то было с полупроводниками.
На фото вы видите пленку графена, открытый в 2004 году группой Гейма-Новоселова, толщиной всего 0,1 нм.
Возможность контролировать и менять свойства таких пленок, приведет к возникновению «думающих» чувствительных поверхностей. Стельки в ваших кроссовках или туфлях, смогут заметить, бежите вы или идете, устали или бодры и в зависимости от этого менять жесткость (форму) подошвы. Стены в квартире будут «знать», где вы находитесь и начнут менять свою светимость. Одежда станет контролировать температуру снаружи и внутри и сможет нагревать или охлаждать ваше тело. Мир станет другим и мы вместе с ним…
Взгляни на атомы, прикоснись к молекуле
Аркадий Курамшин,
кандидат химических наук
«Химия и жизнь» №5, 2017
Принялся Трурль ловить атомы, соскабливать с них электроны, месить протоны, так что лишь пальцы мелькали, приготовил протонное тесто, выложил вокруг него электроны и — за следующий атом; не прошло и пяти минут, как держал он в руках брусочек чистого золота: подал его морде, она же, на зуб брусочек попробовав и головой кивнув, сказала:
— Ничего, мы дадим тебе особый аппаратик! — уговаривал его Трурль.
Станислав Лем, «Кибериада»
Можно ли с помощью микроскопа разглядеть атом, отличить его от другого атома, проследить за разрушением или образованием химической связи и увидеть, как одна молекула превращается в другую? Да, если это не простой микроскоп, а атомно-силовой. А можно и не ограничиваться наблюдением. Мы живем в то время, когда атомно-силовой микроскоп перестал быть просто окном в микромир. Сегодня этот прибор можно использовать для перемещения атомов, разрушения химических связей, изучения предела растяжения одиночных молекул — и даже для исследования генома человека.
Буквы из ксеноновых пикселей
Рассмотреть атомы не всегда было так просто. История атомно-силового микроскопа началась в 1979 году, когда Герд Карл Бинниг и Генрих Рорер, работавшие в Исследовательском центре компании IBM в Цюрихе, приступили к созданию прибора, который позволил бы изучать поверхности с атомным разрешением. Чтобы придумать такое устройство, исследователи решили использовать эффект туннельного перехода — способность электронов преодолевать, казалось бы, непроходимые барьеры. Идея состояла в том, чтобы, измеряя силу туннельного тока, возникающего между сканирующим зондом и изучаемой поверхностью, определять положение атомов в образце.
У Биннига и Рорера получилось, и они вошли в историю как изобретатели сканирующего туннельного микроскопа (СТМ), а в 1986 году получили Нобелевскую премию по физике. Сканирующий туннельный микроскоп совершил настоящую революцию в физике и химии.


В 1990 году Дон Айглер и Эрхард Швайцер, работавшие в исследовательском центре IBM в Калифорнии, показали, что СТМ можно применять не только для наблюдения за атомами, но для манипулирования ими. С помощью зонда сканирующего туннельного микроскопа они создали, возможно, самый популярный образ, символизирующий переход химиков к работе с отдельными атомами — нарисовали на никелевой поверхности три буквы 35 атомами ксенона (рис. 1).
Бинниг не стал почивать на лаврах — в год получения Нобелевской премии совместно с Кристофером Гербером и Кельвином Куэйтом, также работавшими в Цюрихском исследовательском центре IBM он начал работу над еще одним устройством для изучения микромира, лишенного недостатков, которые присущи СТМ. Дело в том, что с помощью сканирующего туннельного микроскопа нельзя было изучать диэлектрические поверхности, а только проводники и полупроводники, да и для анализа последних между ними и зондом микроскопа нужно было создать значительное разрежение. Поняв, что создать новое устройство проще, чем модернизировать существующее, Бинниг, Гербер и Куэйт изобрели атомно-силовой микроскоп, или АСМ. Принцип его работы кардинально иной: для получения информации о поверхности измеряют не силу тока, возникающую между зондом микроскопа и изучаемым образцом, а значение возникающих между ними сил притяжения, то есть слабых нехимических взаимодействий — сил Ван-дер-Ваальса.
Первая рабочая модель АСМ была устроена сравнительно просто. Исследователи перемещали над поверхностью образца алмазный зонд, связанный с гибким микромеханическим датчиком — кантилевером из золотой фольги (между зондом и атомом возникает притяжение, кантилевер гнется в зависимости от силы притяжения и деформирует пьезоэлектрик). Степень изгиба кантилевера определялась с помощью пьезоэлектрических датчиков — сходным образом канавки и гребни виниловой пластинки превращаются в аудиозапись. Конструкция атомно-силового микроскопа позволяла ему детектировать силы притяжения до 10
За три десятка лет, прошедших с тех пор, АСМ использовали для изучения практически любых химических объектов — от поверхности керамического материала до живых клеток и отдельных молекул, причем находящихся как в статическом, так и динамическом состоянии. Атомно-силовая микроскопия стала рабочей лошадкой химиков и материаловедов, а количество работ, в которых применяется этот метод, постоянно растет (рис. 2).
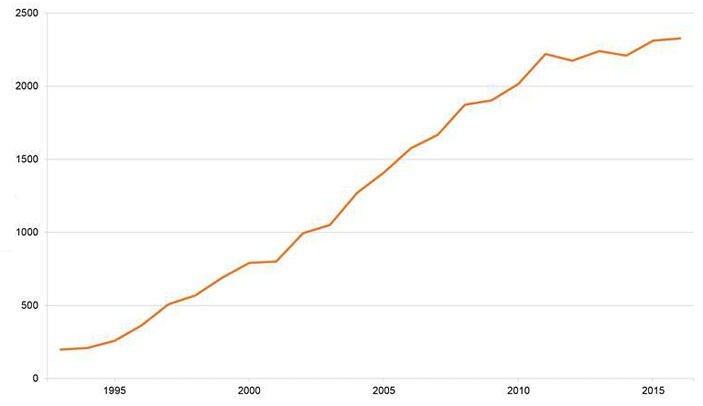
За эти годы исследователи подобрали условия и для контактного, и для бесконтактного изучения объектов с помощью атомно-силовой микроскопии. Контактный метод описан выше, он основан на вандерваальсовом взаимодействии между кантилевером и поверхностью. При работе в бесконтактном режиме пьезовибратор возбуждает колебания зонда на некоторой частоте (чаще всего резонансной). Сила, действующая со стороны поверхности, приводит к тому, что и амплитуда, и фаза колебаний зонда изменяются. Несмотря на некоторые недостатки бесконтактного метода (в первую очередь чувствительность к внешним шумам), именно он исключает воздействие зонда на исследуемый объект, а значит, интереснее для химиков.
Живо по зондам, в погоню за связями
Бесконтактной атомно-силовая микроскопия стала в 1998 году благодаря работам ученика Биннига — Франца Йозефа Гиссибла. Именно он предложил использовать в качестве кантилевера кварцевый эталонный генератор стабильной частоты. Спустя 11 лет исследователи из лаборатории IBM в Цюрихе предприняли еще одну модификацию бесконтактного АСМ: роль зонда-сенсора выполнял не острый кристалл алмаза, а одна молекула — монооксид углерода. Это позволяло перейти к субатомному разрешению, что и продемонстрировал Лео Гросс из цюрихского отдела IBM. В 2009 году с помощью АСМ он сделал видимыми уже не атомы, а химические связи, получив достаточно четкую и однозначно читаемую «картинку» для молекулы пентацена (рис. 3;
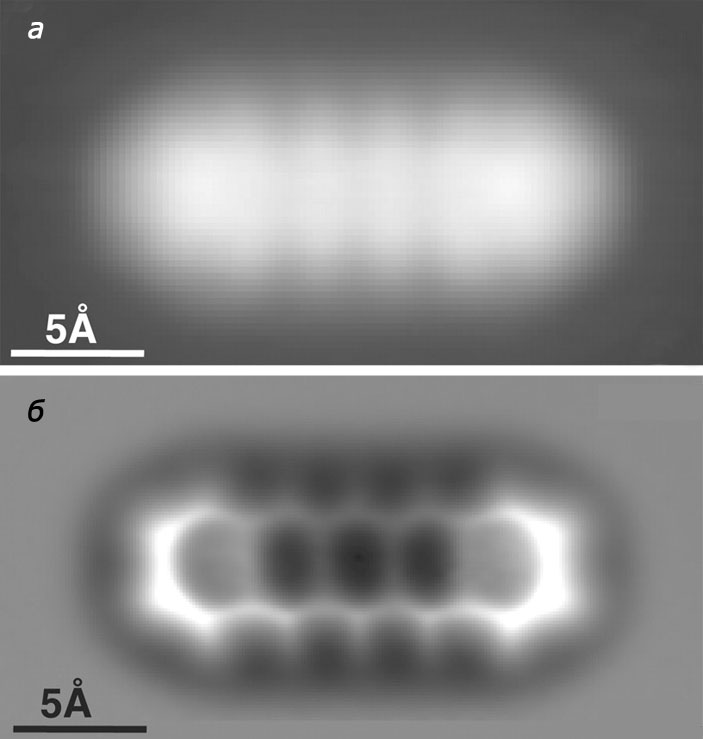
Убедившись, что с помощью АСМ можно увидеть химическую связь, Лео Гросс решил пойти дальше и применить атомно-силовой микроскоп для измерения длин и порядков связей — ключевых параметров для понимания химической структуры, а следовательно, и свойств веществ.
Напомним, что различие в порядках связей указывает на разные значения электронной плотности и различные межатомные расстояния между двумя атомами (говоря проще, двойная связь короче одинарной). В этане порядок связи углерод-углерод равен единице, в этилене — двум, а в классической ароматической молекуле — бензоле — порядок связи углерод-углерод больше единицы, но меньше двух, и считается равным 1,5.
Определить порядок связи гораздо сложнее при переходе от простых ароматических систем к плоским или объемным поликонденсированным циклическим системам. Так, порядок связей в фуллеренах, состоящих из конденсированных пяти- и шестичленных углеродных циклов, может принимать любое значение от единицы до двух. Та же самая неопределенность теоретически присуща и полициклическим ароматическим соединениям.

В 2012 году Лео Гросс совместно с Фабианом Моном показал, что атомно-силовой микроскоп с металлическим бесконтактным зондом, модифицированным монооксидом углерода, может измерять различия в распределении зарядов у атомов и межатомные расстояния — то есть параметры, ассоциированные с порядком связи (Science, 2012, 337, 6100, 1326–1329, doi: 10.1126/science.1225621).
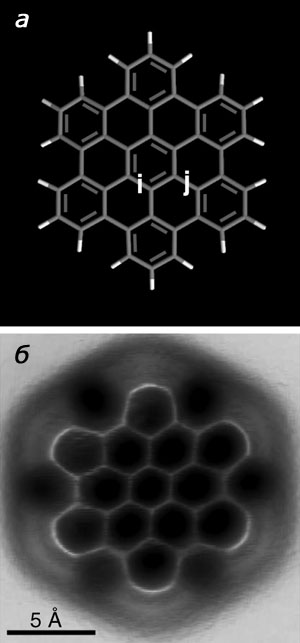
Для этого они изучили два типа химических связей в фуллерене — связь углерод-углерод, общую для двух шестичленных углеродсодержащих циклов фуллерена С60, и связь углерод-углерод, общую для пяти- и шестичленного циклов. Атомно-силовой микроскоп показал, что при конденсации шестичленных циклов образуется связь более короткая и с большим порядком, чем при конденсации циклических фрагментов C6 и C5. Изучение же особенностей химического связывания в гексабензокоронене, где вокруг центрального цикла C6 симметрично расположено еще шесть циклов C6, подтвердило результаты квантово-химического моделирования, согласно которым порядок связей С—С центрального кольца (на рис. 4 буква i) должен быть больше, чем у связей, объединяющих это кольцо с периферийными циклами (на рис. 4 буква j). Сходные результаты получили и для более сложного полициклического ароматического углеводорода, содержащего девять шестичленных циклов.
Порядки связей и межатомные расстояния, конечно же, интересовали химиков-органиков, но важнее это было тем, кто занимался теорией химической связи, предсказанием реакционной способности и изучением механизмов химических реакций. Тем не менее и химиков-синтетиков, и специалистов по изучению структуры природных соединений ждал сюрприз: оказалось, что атомно-силовой микроскоп можно применять для установления структуры молекул точно так же, как ЯМР или ИК-спектроскопию. Более того, он дает однозначный ответ на вопросы, с которыми эти методы не в состоянии справиться.
От фотографии к кинематографу
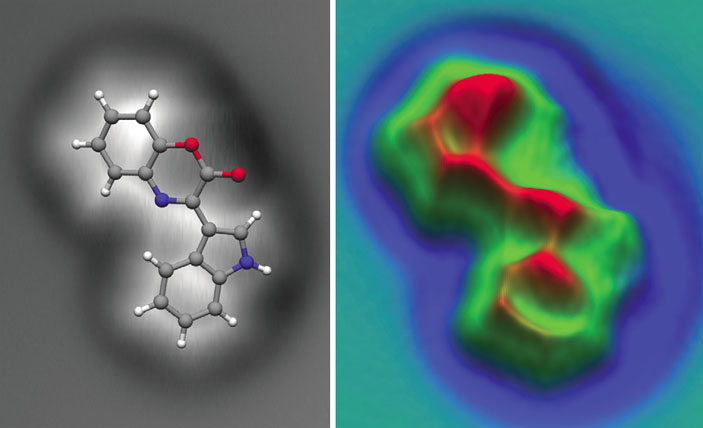
В 2010 году все тот же Лео Гросс и Райнер Эбел смогли однозначно установить строение природного соединения — цефаландола А, выделенного из бактерии Dermacoccus abyssi (Nature Chemistry, 2010, 2, 821–825, doi: 10.1038/nchem.765). Состав цефаландола А установили ранее с помощью масс-спектрометрии, однако анализ спектров ЯМР этого соединения не давал однозначного ответа на вопрос о его структуре: возможны были четыре варианта. С помощью атомно-силового микроскопа исследователи сразу же исключили две из четырех структур, а из двух оставшихся правильный выбор сделали, сравнив результаты, полученные благодаря АСМ и квантово-химическому моделированию. Задача оказалась непростой: в отличие от пентацена, фуллерена и короненов, в состав цефаландола А входят не только атомы углерода и водорода, кроме того, у этой молекулы нет плоскости симметрии (рис. 5) — но и такую задачу удалось решить.
Еще одно подтверждение того, что атомно-силовой микроскоп можно использовать как аналитический инструмент, получили в группе Оскара Кустанца, в то время работавшего в инженерной школе Университета Осаки. Он показал, как с помощью АСМ различить атомы, отличающиеся друг от друга гораздо меньше, чем углерод и водород (Nature, 2007, 446, 64–67, doi: 10.1038/nature05530). Кустанц исследовал поверхность сплава, состоящего из кремния, олова и свинца с известным содержанием каждого элемента. В результате многочисленных экспериментов он выяснил, что сила, возникающая между острием зонда АСМ и разными атомами, различается (рис. 6). Так, например, самое сильное взаимодействие наблюдалось при зондировании кремния, а самое слабое — при зондировании свинца.
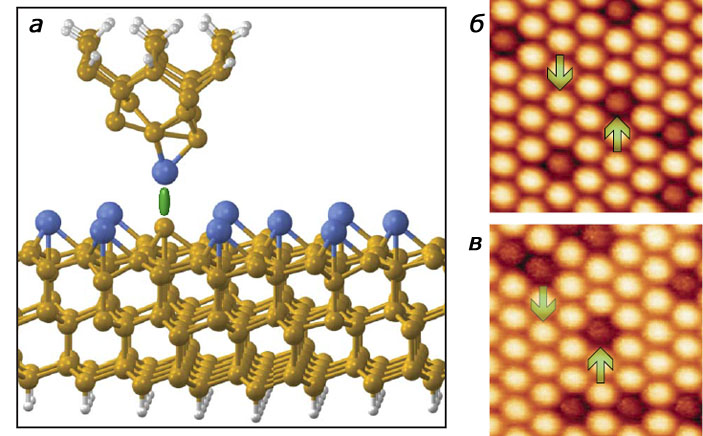
Предполагается, что в дальнейшем результаты атомно-силовой микроскопии для распознавания отдельных атомов будут обрабатываться так же, как результаты ЯМР, — по сравнению относительных величин. Поскольку точный состав иглы датчика трудно контролировать, абсолютное значение силы между датчиком и различными атомами поверхности зависит от условий эксперимента и марки устройства, а вот отношение этих сил при любом составе и форме датчика остается постоянным для каждого химического элемента.
В 2013 году появились первые примеры использования АСМ для получения изображений отдельных молекул до и после химических реакций: создается «фотосет» из продуктов и полупродуктов реакции, который потом можно смонтировать своего рода документальный фильм (Science, 2013, 340, 6139, 1434–1437; doi: 10.1126/science.1238187).
Феликс Фишер и Майкл Кромми из Университета Калифорнии в Беркли нанесли на поверхность серебра 1,2-бис[(2-этинилфенил)этинил]бензол, получили изображение молекул и нагрели поверхность, чтобы инициировать циклизацию. Половина исходных молекул превратилась в полициклические ароматические структуры, состоящие из конденсированных пяти шестичленных и двух пятичленных циклов. Еще четверть молекул образовала структуры, состоящие из четырех шестичленных циклов, связанных через один четырехчленный цикл, и двух пятичленных циклов (рис. 7) . Остальными продуктами были олигомерные структуры и, в незначительном количестве, полициклические изомеры.
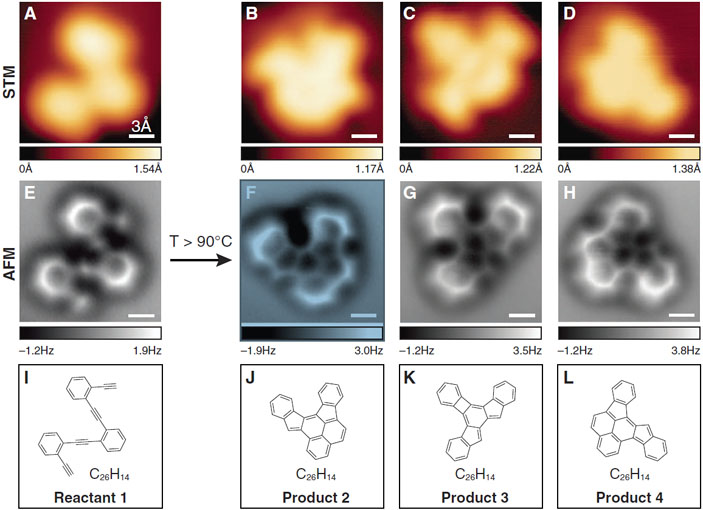

Такие результаты дважды удивили исследователей. Во-первых, в ходе реакции образовалось всего лишь два главных продукта. Во-вторых, удивление вызвала их структура. Фишер отмечает, что химическая интуиция и опыт позволяли нарисовать десятки возможных продуктов реакции, однако ни один из них не соответствовал тем соединениям, которые образовывались на поверхности. Возможно, протеканию нетипичных химических процессов способствовало взаимодействие исходных веществ с подложкой.
Естественно, что после первых серьезных успехов в изучении химических связей некоторые исследователи решили применить АСМ для наблюдения более слабых и менее изученных межмолекулярных взаимодействий, в частности водородной связи. Однако в этой области работы еще только начинаются, а результаты их противоречивы. Так, в одних публикациях сообщается, что атомно-силовая микроскопия позволила наблюдать водородную связь (Science, 2013, 342, 6158, 611–614, doi: 10.1126/science.1242603), в других утверждают, что это всего лишь артефакты, обусловленные конструкционными особенностями прибора, а экспериментальные результаты нужно интерпретировать аккуратнее (Physical Review Letters, 2014, 113, 186102, doi: 10.1103/PhysRevLett.113.186102). Возможно, окончательный ответ на вопрос, можно ли наблюдать водородные и другие межмолекулярные взаимодействия с помощью атомно-силовой микроскопии, будет получен уже в этом десятилетии. Для этого необходимо еще хотя бы в несколько раз повысить разрешение АСМ и научиться получать изображения без помех (Physical Review B, 2014, 90, 085421, doi: 10.1103/PhysRevB.90.085421).
Синтез одной молекулы
В умелых руках и СТМ и АСМ превращаются из приборов, способных изучать вещество, в приборы, способные направленно изменять строение вещества. С помощью этих устройств уже удалось получить «самые маленькие химические лаборатории», в которых вместо колбы используется подложка, а вместо молей или миллимолей реагирующих веществ — отдельные молекулы.
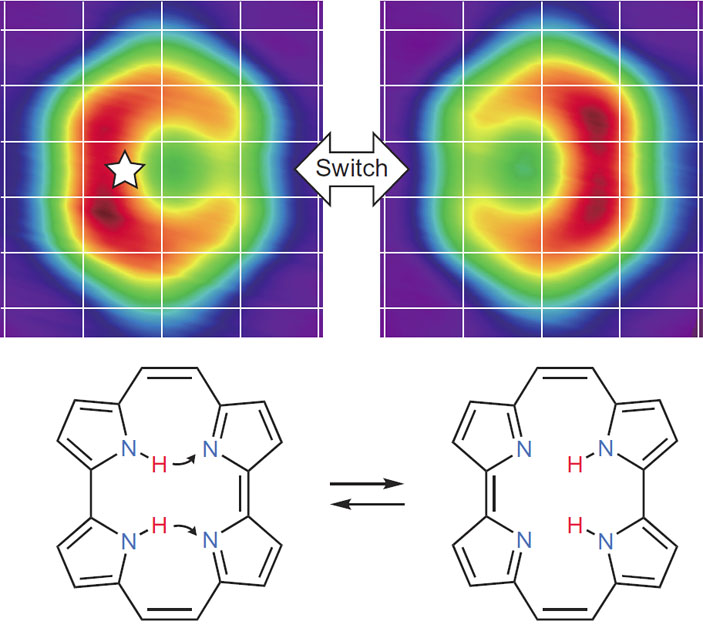
Например, в 2016 году международная группа ученых во главе с Такаси Кумагаи использовала бесконтактную атомно-силовую микроскопию для перевода молекулы порфицена из одной ее формы в другую (Nature Chemistry, 2016, 8, 935–940, doi: 10.1038/nchem.2552). Порфицен можно рассматривать как модификацию порфирина, во внутреннем цикле которого содержится четыре атома азота и два атома водорода. Колебания зонда АСМ передавали молекуле порфицена достаточно энергии для переноса этих водородов от одних атомов азота к другим, и в результате получалось «зеркальное отражение» этой молекулы (рис. 8).
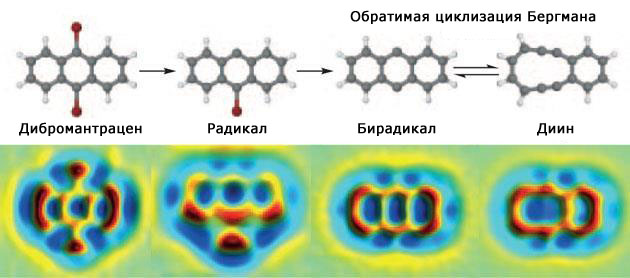
Группа под руководством неутомимого Лео Гросса также показала, что возможно инициировать реакцию отдельно взятой молекулы, — они превратили дибромантрацен в десятичленный циклический диин (рис. 9; Nature Chemistry, 2015, 7, 623–628, doi: 10.1038/nchem.2300). В отличие от Кумагаи с соавторами, они использовали сканирующий туннельный микроскоп для активации молекулы, а за результатом реакции следили с помощью атомно-силового микроскопа.
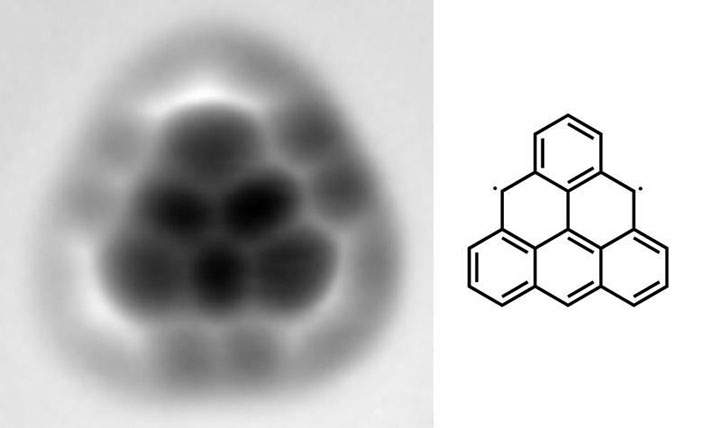
Комбинированное применение сканирующего туннельного микроскопа и атомно-силового микроскопа позволило даже получить молекулу, которую невозможно синтезировать с помощью классических приемов и методов (Nature Nanotechnology, 2017, 12, 308–311, doi: 10.1038/nnano.2016.305). Это триангулен — нестабильный ароматический бирадикал, существование которого было предсказано шесть десятилетий назад, но все попытки синтеза были неудачными (рис. 10). Химики из группы Нико Павличека получили искомое соединение, оторвав от его прекурсора два атома водорода с помощью СТМ и подтвердив синтетический результат с помощью АСМ.
Предполагается, что число работ, посвященных применению атомно-силовой микроскопии в органической химии, еще будет расти. В настоящее время все больше ученых пытаются повторить на поверхности реакции, хорошо знакомые «растворной химии». Но, возможно, химики-синтетики начнут воспроизводить в растворе те реакции, которые были первоначально осуществлены на поверхности с помощью АСМ.
От неживого — к живому
Кантилеверы и зонды атомно-силовых микроскопов можно применять не только для аналитических исследований или синтеза экзотических молекул, но и для решения прикладных задач. Уже известны случаи использования АСМ в медицине, например для ранней диагностики рака, и здесь пионером выступает тот самый Кристофер Гербер, который приложил руку к разработке принципа атомно-силовой микроскопии и созданию АСМ.
Так, Герберу удалось научить АСМ определять точечную мутацию рибонуклеиновой кислоты при меланоме (на материале, полученном в результате биопсии). Для этого золотой кантилевер атомно-силового микроскопа модифицировали олигонуклеотидами, которые могут вступать в межмолекулярное взаимодействие с РНК, а силу этого взаимодействия все также можно измерить за счет пьезоэффекта. Чувствительность сенсора АСМ настолько велика, что его уже пытаются применить для изучения эффективности популярного метода редактирования геномов CRISPR-Cas9. Здесь воедино объединяются технологии, созданные разными поколениями исследователей.
Перефразируя классика одной из политических теорий, можно сказать, что мы уже сейчас видим безграничные возможности и неисчерпаемость атомно-силовой микроскопии и вряд ли в силах представить, что ждет нас впереди в связи с дальнейшим развитием этих технологий. Но уже сегодня сканирующий туннельный микроскоп и атомно-силовой микроскоп дают нам возможность увидеть атомы и прикоснуться к ним. Можно сказать, что это не только продолжение наших глаз, позволяющее заглянуть в микрокосм атомов и молекул, но и новые глаза, новые пальцы, способные прикоснуться к этому микрокосму и управлять им.
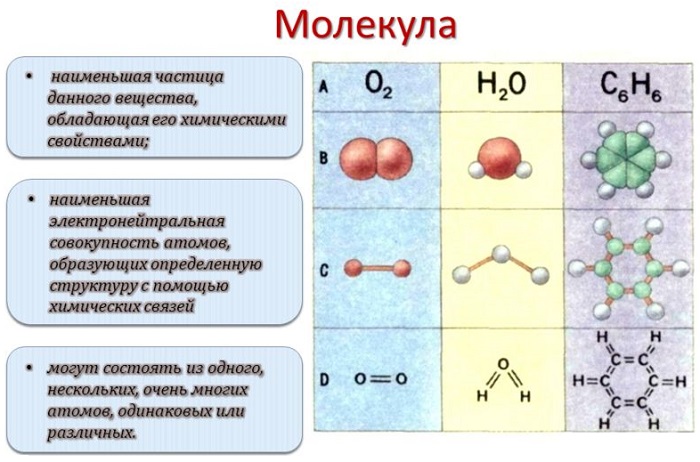
Молекула ☑️ определение в химии и физике, строение и размеры, виды химической связи, свойства, структура и формы молекул для разных веществ
Одним из основополагающих понятий современной науки является понятие молекулы. Его введение европейскими учеными в 1860 г. дало толчок к развитию не только химии и физики, но и других естественных наук.
Молекулой, в наиболее общем определении, называется частица, образованная из нескольких (двух или более) атомов, объединенных между собой ковалентными связями. Она не имеет электрического заряда, все электроны в её составе имеют пару.
Молекулы, несущие заряд, называются ионами, неспаренные электроны – радикалами. Качественный и количественный состав их стабилен. Количество ядер атомов, электронов и их взаимное расположение позволяют отличать молекулы разных веществ друг от друга.
Что такое молекула в физике
В физике этим понятием оперируют при изучении свойств разных сред (газы, жидкости) и твердых тел.

Также их свойствами объясняются явления диффузии, теплопроводности и вязкость веществ.
Что такое молекула в химии
Учение о молекулах для химической науки является одним из самых главных. Именно химические исследования дали важнейшие сведения о составе и свойствах этой мельчайшей единицы вещества.
При прохождении химического превращения молекулы обмениваются атомами, распадаются. Поэтому знания о строении и состоянии этих частиц лежат в основе изучения химии веществ и их превращений.
На основании знаний о проходящей химической реакции можно предсказать строение молекул веществ, в ней участвующих. Противоположное заключение тоже будет верным: на основании сведений о строении молекулы вещества реально предсказать его поведение во время химической реакции.
Строение молекулы
Понятие о строении включает геометрическую структуру и распределение электронной плотности.
В качестве примера рассмотрим строение наименьшей частицы воды.
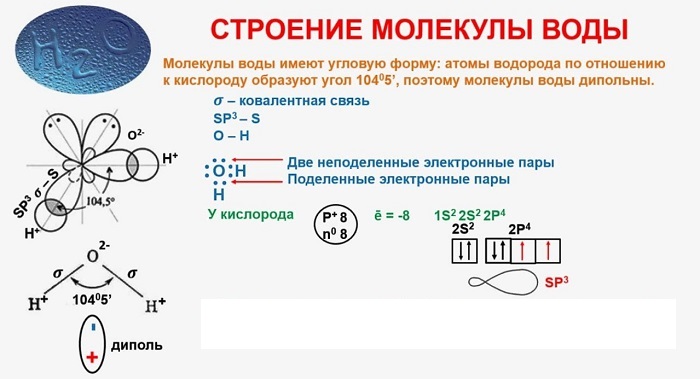
Существует несколько способов взаимодействия атомов. Основным способом являются химические связи, благодаря им поддерживается стабильное существование молекул. Прочие (неосновные) взаимодействия происходят между теми атомами, которые не связаны непосредственно.
Виды химической связи:
-
Металлическая — ядра атомов металлов, расположенные в узлах кристаллических решёток, объединены общим облаком электронов.
-
Водородная — основана на способности атома водорода образовывать дополнительную связь при смещении от него электронной плотности.
-
Ионная — имеет электрическую природу. Сильно поляризована. Возникает при притяжении ионов, несущих противоположный заряд.
-
Ковалентная — может быть полярной и неполярной. Образуется за счет пары электронов, совместно принадлежащей двум атомам. Отличается наибольшей устойчивостью и энергетической емкостью.
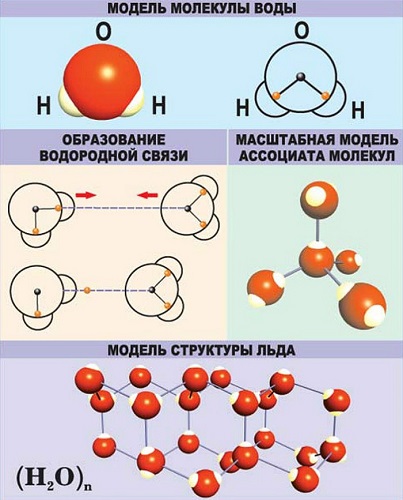
Связи характеризуются следующими показателями:
-
длина – степень удаления друг от друга ядер атомов, образовавших связь;
-
энергия – сила, прилагаемая для разрушения связи;
-
полярность – смещение электронного облака к одному из атомов;
-
порядок или кратность – количество пар электронов, образовавших связь.
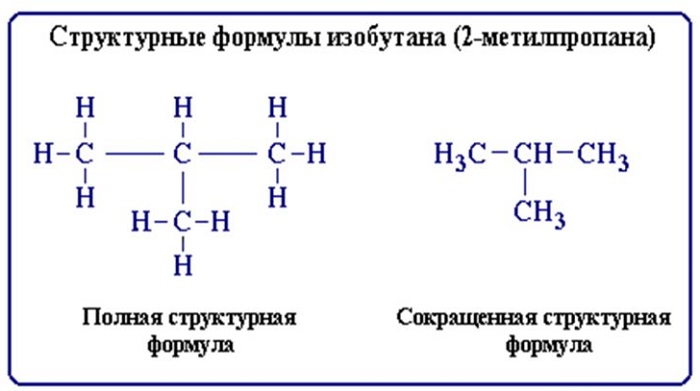
Строение молекул условно отражается структурными формулами. Основные взаимодействия атомов, при составлении таких формул, отображается черточками. В таких формулах связи образуют неразрывную цепь и иллюстрируют валентности образовавших их элементов (атомов).
Структурные формулы также отражают то, как выглядит молекула (линейная, циклическая, наличие радикалов и т. д.).
Строение частицы вещества активно изучается. Для этого используют различные экспериментальные и теоретические методы. К экспериментальным относят рентгеновский структурный анализ, спектроскопия, массспектрометрия и др. К теоретическим — расчётные методы квантовой химии.
Масса (размер) молекулы
В зависимости о количества ядер атомов, входящих в их состав, можно выделить молекулы двухатомные, трехатомные и т. д.

В том случае, если количество атомов велико, молекула носит название макромолекулы.
Путем сложения масс атомов, входящих в состав частицы, можно определить молекулярную массу. В зависимости от её величины, все вещества делят на высоко- и низкомолекулярные.
Свойства молекулы

Современная наука выделяет следующие свойства молекул:
-
Электрические — этими свойствами определяется то, как ведет себя вещество в электрическом поле. Атомы, входящие в состав молекулы, состоят, в свою очередь, из положительно заряженного ядра и электронов, несущих отрицательный заряд. Эти заряды внутри самой молекулы располагаются неравномерно, в связи с этим возникает так называемый дипольный момент и смещение электронной плотности в сторону одного из атомов.
-
Оптические — дают характеристику того, как ведет себя вещество в поле световой волны. К оптическим свойствам относят способность поляризовать свет, преломлять его и рассеивать.
-
Магнитные — объясняются распределением электронов в атомах.
Различают вещества:
Знания о свойствах и строении молекул являются основополагающими для развития теоретических и прикладных наук и играют важную роль в жизни человека.
Модели молекул: Углеводороды и их производные
Ациклические
Метан
Метан
Этан
Этан
Этан
Пропан
Пропан
Пропан
Пропан
Бутан
Бутан
Бутан
Бутан
Изобутан
Изобутан
Пентан
Неопентан
Этилен
Этилен
Этилен
Бутен-1
Бутен-2
Бутен-2
Бутен-2
Пропен
Пропен
Изопрен
Пропадиен
Пропадиен
2-метилпропен-1
Бутадиен-1,3
Ацетилен
Ацетилен
Ацетилен
Бутин
Винилхлорид
Бутатриен
Фтороформ
Циклические
Адамантан
Акридин
Бензол
Азулен
Бицикло-2,2,2-октан
Бицикло-3,3,0-октан
Бицикло-4,2,0-октан
Бицикло-4,2,0-октан
Хлорбензол
Хлорбензол
Цис-бицикло-4,4,0-декан
Циклопропан
Циклобутан
Циклопентан
Циклогексан
Циклогептан
Циклооктан
Циклононан
Циклопропен
Циклопропен
Циклооктин
Фуран
Гексахлорциклогексан
Индол
Индолизин
Изоксазол
Карбазол
N-1,2,3-триазол
N-1,2,4-триазол
Нафталин
Норборнан
Оксазол
Пиразол
Пиридин
Пиримидин
Пиррол
Порфин
Пурин
Тетразол
Тиадиазол
Имидазол
Имидазол
Имидазол
Тиантрен
Тиазол
Тиофен
Толуол
Транс-бицикло-4,4,0-декан
1,2-Нафтохинон
Молекулы — урок. Химия, 8–9 класс.
Молекулы характеризуются качественным и количественным составом.
Качественный состав показывает, из каких атомов состоит молекула.
Пример:
молекулы воды и пероксида водорода состоят из атомов водорода и кислорода, а молекула углекислого газа — из атомов углерода и кислорода.
Количественный состав показывает, сколько атомов каждого вида содержится в молекуле.
Пример:
молекула воды состоит из двух атомов водорода и одного атома кислорода, а молекула пероксида водорода — из двух атомов водорода и двух атомов кислорода.
В молекулах может быть разное число атомов.
У инертных газов гелия, неона, аргона, криптона, ксенона, радона молекулы одноатомные.
Молекулы кислорода, водорода, азота, хлора, брома, иода двухатомные.
Молекула озона состоит из \(3\) атомов, а серы — из \(8\).
Молекула этилового спирта содержит \(2\) атома углерода, \(6\) атомов водорода и \(1\) атом кислорода, а молекула сахара — \(12\) атомов углерода, \(22\) атома водорода и \(11\) атомов кислорода.
Модели молекул: \(1\) — азота, \(2\) — кислорода,
\(3\) — неона, \(4\) — углекислого газа, \(5\) — воды,
\(6\) — озона, \(7\) — терпинеола
Химические свойства молекулы определяются тем, сколько и каких атомов в ней содержится, а также в каком порядке они соединены друг с другом.
Пример:
молекулы кислорода и озона отличаются только количественным составом. Кислород — газ без запаха. Необходим живым организмам для дыхания. Озон имеет запах, может вызывать отравление.
В химических реакциях молекулы не сохраняются, а разрушаются до атомов.
Молекулы без химических связей
Алексей Паевский
«Популярная механика» №6, 2015
В школе мы учили на уроках химии, что атомы в молекулах удерживаются химической связью: ковалентной полярной, ковалентной неполярной… Бывает ионная связь — в кристаллах, бывают связи двухцентровые и многоцентровые. А можно ли построить классическую молекулу, например органического вещества, без химической связи? Как ни странно, правильный ответ на этот вопрос «отчасти — да». Бывают молекулы, разные части которых удерживаются исключительно механически. Но обо всём по порядку.
Супрамолекулярная химия
Можно сказать, что такие молекулы, где одна часть удерживается в другой чисто механически, случайно синтезировал в 1967 году сотрудник компании DuPont Чарльз Педерсен. Он получил ставшие знаменитыми краун-эфиры, которые как корона «надеваются» на большой ион щелочного металла и образуют устойчивые комплексы. Однако, конечно, несмотря на Нобелевскую премию по химии 1987 года, которую получил Педерсен, назвать совсем механической такую связь нельзя — взаимодействие в комплексе происходит между атомами кислорода или азота и щелочными металлами.
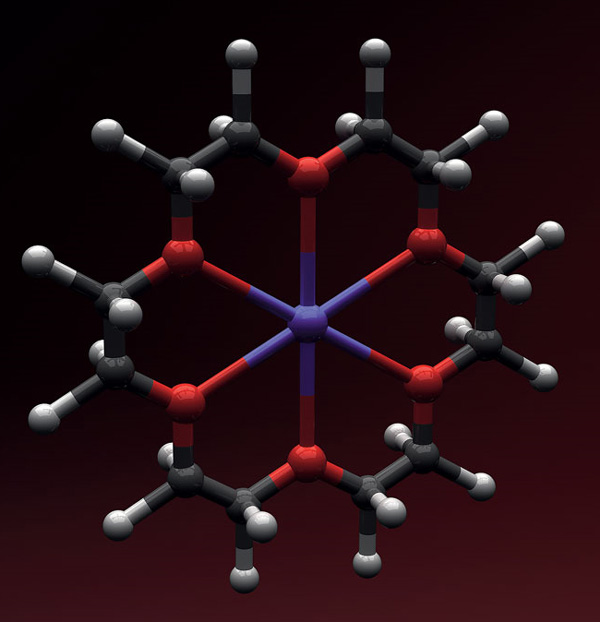
Чуть более жесткими эти комплексы сделал второй лауреат того же года — Жан-Мари Лен, создавший криптанды. Его вещества были уже не короной, а целой чашкой — ровно на один или два иона. Тем не менее взаимодействие между гостем и хозяином в комплексе было все еще не только механическим. Однако именно Лен дал название науке, которая занимается подобными веществами, супрамолекулярная химия — «химия, вышедшая за пределы молекулы».
Сделать то, о чем мы говорим, смог третий лауреат 1987 года, Дональд Джеймс Крам, который, развивая идею комплексов «гость–хозяин», создал новый тип молекул — карцеранды. Эта органическая молекула представляет собой «клетку», «карцер», внутри которого заключена другая молекула, будь то большой атом инертного газа или, скажем, маленькая молекула органического вещества.
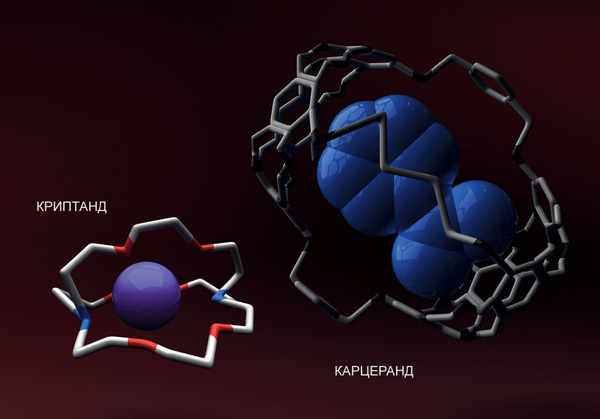

Однако хочется чего-то большего: в карцеранде части молекулы неравноправны, одна «спрятана» внутри другой. Можно представить себе еще более восхитительные варианты. Существует целых четыре типа молекул с настоящей механической связью, и все они были синтезированы в лабораториях. Для них даже была придумана общая аббревиатура MIMA. В переводе на русский — «механически запертые молекулярные архитектуры» (mechanically interlocked molecular architectures).
Вот эти четыре типа: катенаны, ротаксаны, молекулярные узлы и молекулярные кольца Борромео. Все эти молекулы отличает то, что их части удерживает вместе исключительно механическое взаимодействие — физическое соприкосновение частей не дает им распасться или изменить взаимоположение. Давайте посмотрим, что это за молекулы.
Катенаны
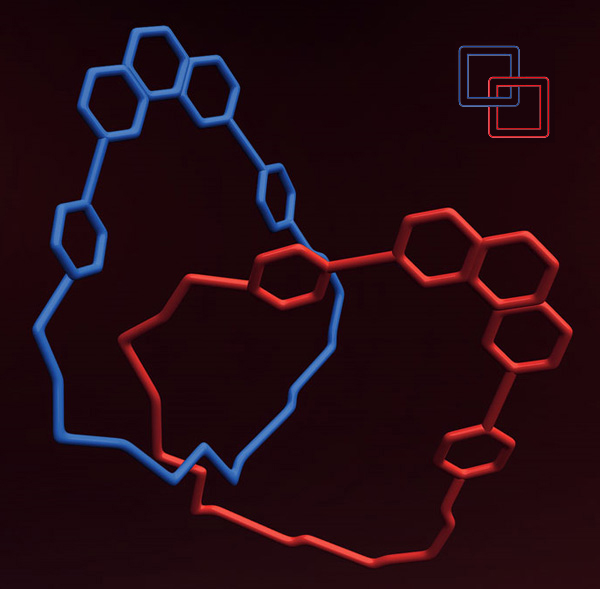
Действительно, катенаны — это два или более замкнутых цикла, продетых друг в друга.
Первые синтезы катенанов представляли собой реакции циклизации длинных цепочек в присутствии других кольцевых молекул. Надеялись лишь на случай: вдруг какая-то часть молекул во время замыкания циклов окажется продетой в уже существующий цикл. Однако выходы таких реакций всегда оказываются микроскопическими.
Поэтому Готфридом Шиллом, первопроходцем этой темы, был разработан направленный метод синтеза, когда сперва будущие кольца соединены перемычками, а после того как два или три звена цепочки колец собраны, перемычки разрушались. Первый [2]-катенан (два продетых друг в друга кольца) получилось «построить» еще до синтеза первых краун-эфиров, в 1964 году. В 1969 году появился и [3]-катенан. Опять же трудами Шилла.
За последующие годы прогресс в синтезе катенанов оказался огромным. К примеру, сэр Джеймс Фрезер Стоддарт (получивший рыцарское звание за свои успехи в органическом синтезе) в 1994 году сумел соединить, подобно известной эмблеме, пять колец. Разумеется, этот [5]-катенан назвали «олимпиаданом». А рекордное количество звеньев в таких цепочках пока что равно семи.
Кроме того, появились новые типы катенанов: претцеланы, в которых кольца продеты друг в друга, но еще и соединены молекулярным мостиком. Также синтезированы «катенаны в форме наручников» (вполне официальное название — handcuff-shaped catenanes). Почему они так названы, можно понять, посмотрев на их топологию.
Кстати, существуют катенаны и в природе — молекулярным биологам давно известны катенановые ДНК.
Ротаксаны
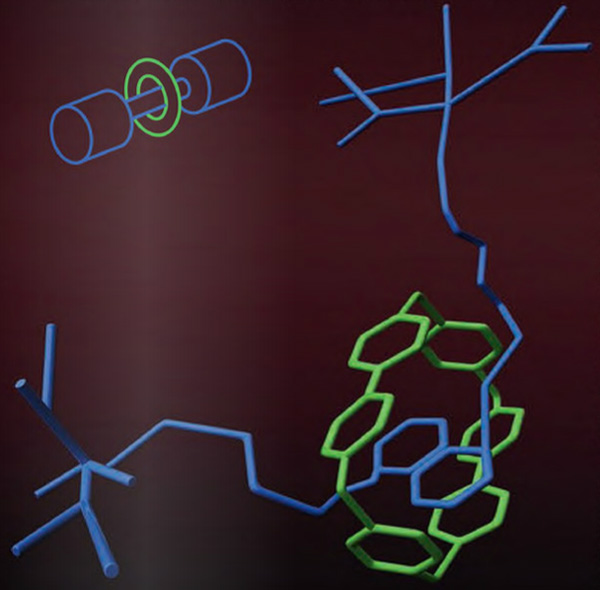
Такие молекулы представляют собой длинную молекулярную цепочку, продетую сквозь цикл. Однако соскользнуть с оси циклу мешают массивные группы атомов на концах цепи. Пионером здесь тоже оказался Готфрид Шилл — первый направленный синтез ротаксана он провел еще в 1968 году.
Сейчас именно ротаксаны стали объектом пристального внимания и биологов, и нанотехнологов. Современные ученые рассматривают такие структуры как элементы молекулярных машин — уже построены ротаксановые молекулярные переключатели, «молекулярные мышцы», которые позволяют осуществлять механическое движение частей молекул и на их основе строить самые маленькие нанороботы. Кроме того, молекулярные биологи уже обнаружили аналоги ротаксанов в природе — на ротаксановом принципе построено действие так называемых лассо-пептидов, которые обхватывают свою цель, стягивая цикл. Среди таких пептидов обнаружены и новые антибиотики.
Молекулярные кольца Борромео
Простые кольца Борромео видели все, хотя и не знали, что они так называются. Это просто три кольца, попарно продетые друг в друга. Термин происходит от названия браслета, принадлежавшего итальянскому аристократическому семейству Борромео.
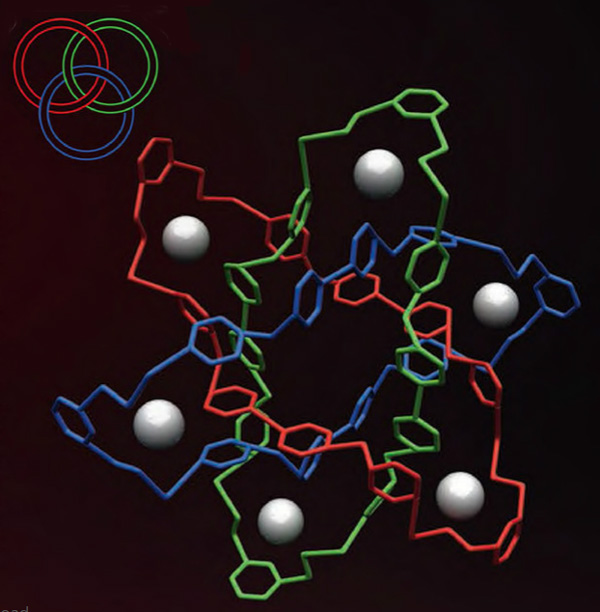
Сравнительно недавно химики научились синтезировать и такие молекулы. Вот, посмотрите на структуру. В 2004 году Джеймс Фрезер Стоддарт сумел путем красивой сборки из 18 компонентов получить эту сложную молекулу. Годом позже знаменитая медиакомпания Thomson Reuters даже предрекала Стоддарту Нобелевскую премию по химии по совокупности умопомрачительных синтезов, но пока что это предсказание не сбылось.
Молекулярные узлы
Здесь все просто: молекула представляет собой неразрывную замкнутую структуру, к тому же завязанную в узел. Химики называют такие молекулы кнотанами — от английского слова knot — «узел».
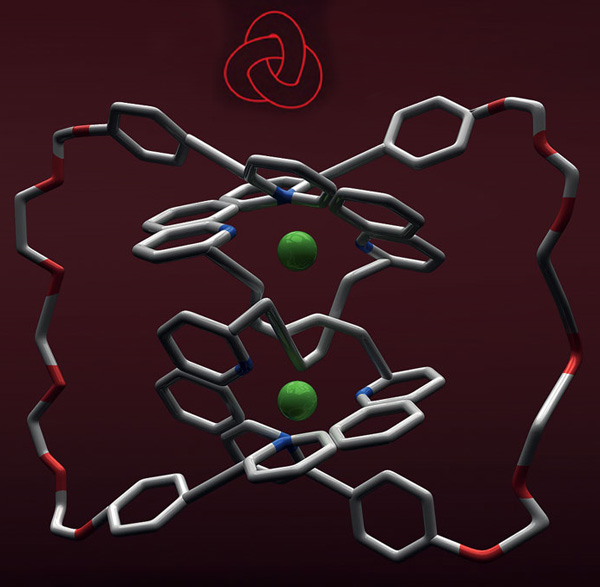
Органики научились синтезировать и такое, и даже несколько узлов одновременно. Первый узел в форме трилистника был синтезирован французским химиком Жаном-Полем Саважем в 1989 году.
Существуют и биологические «узлы». Среди них — достаточно важный человеческий гликопротеин лактоферрин, который встречается в молоке, слезах и других выделениях человека.
